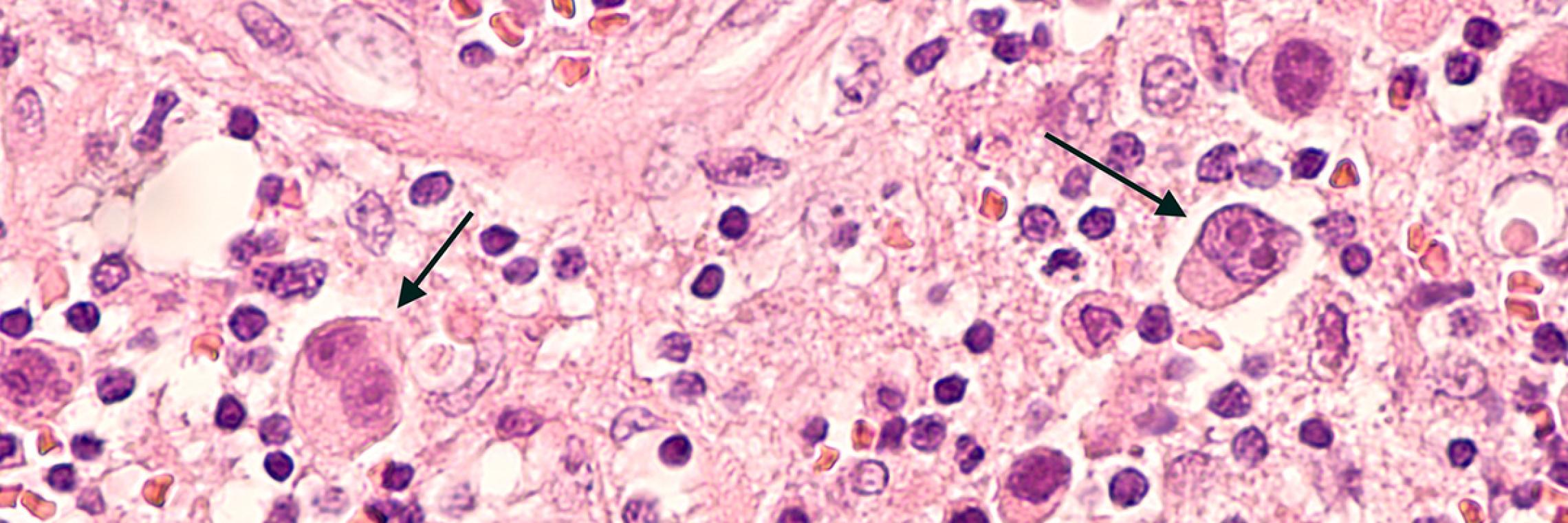
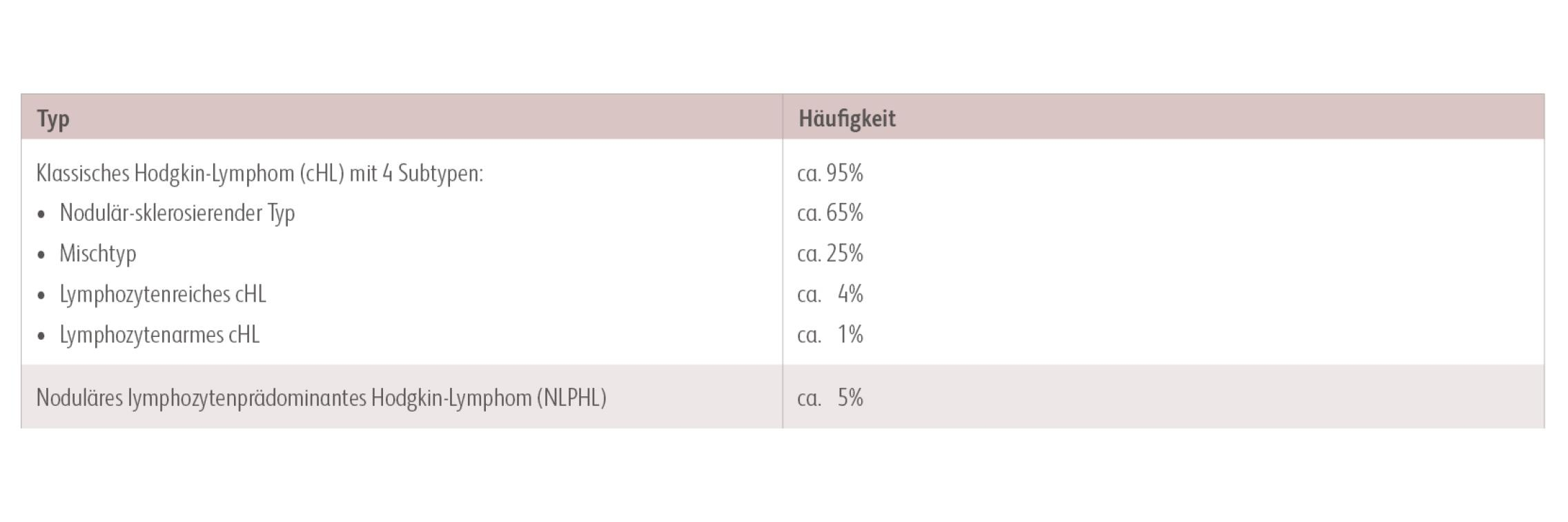
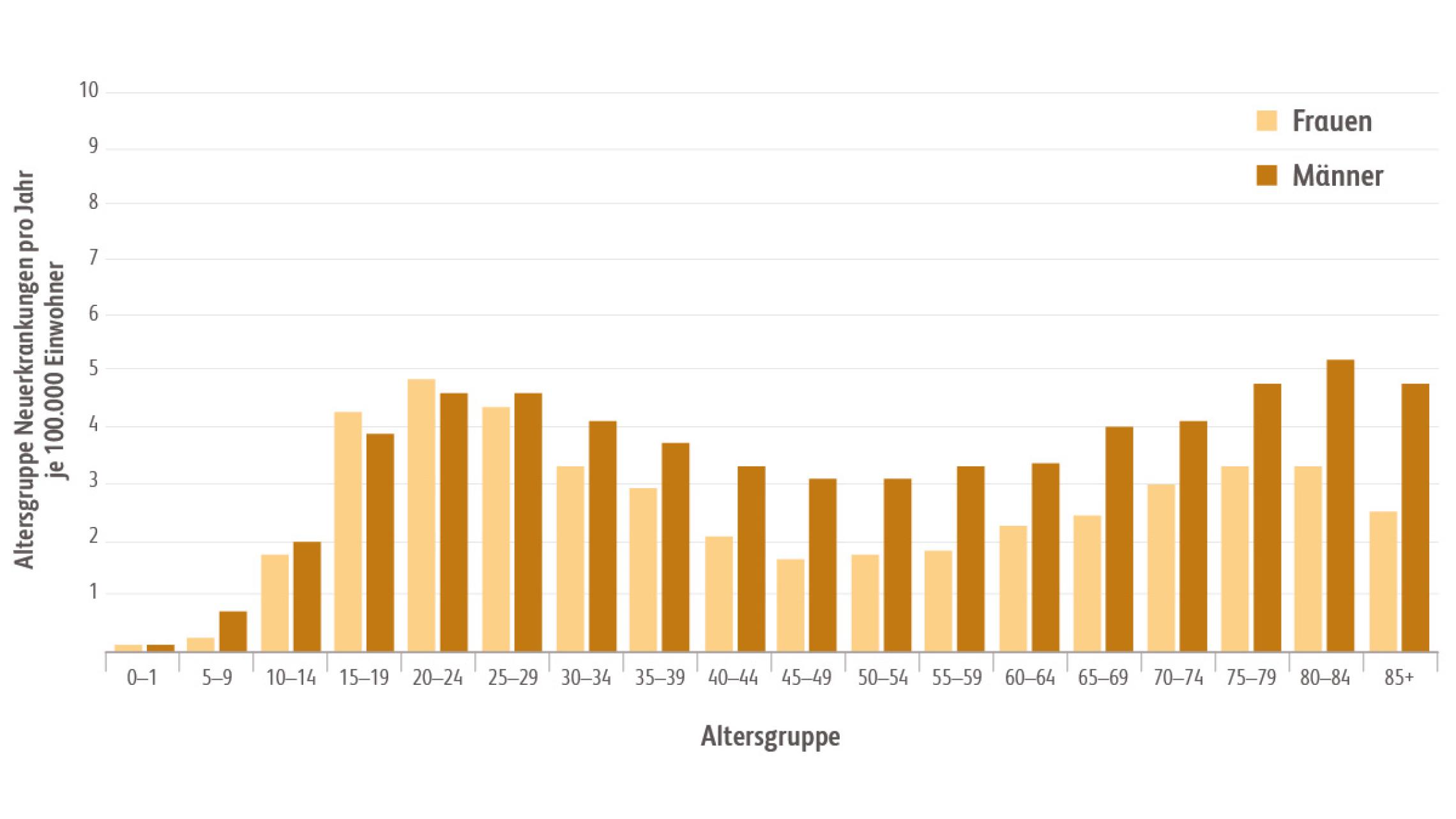
Das Hodgkin-Lymphom ist eine maligne Erkrankung des lymphatischen Systems. Für die Abgrenzung gegenüber Non-Hodgkin-Lymphomen entscheidend sind die beim Hodgkin-Lymphom nachweisbaren malignen Reed-Sternberg (RS)-Zellen. Diese stammen überwiegend von im Keimzentrum des Lymphknotens gebildeten B-Lymphozyten ab.DGHO. Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e. V. Hodgkin Lymphom – Onkopedia. Stand: Januar 2018. https://www.onkopedia.com/de/onkopedia/guidelines/hodgkin-lymphom/@@guideline/html/index.html; abgerufen am 25.11.2019. Ansell SM. Hodgkin Lymphoma: Diagnosis and Treatment. Mayo Clin Proc 2015; 90: 1574-1583. Nach der WHO-Klassifikation lassen sich histologisch folgende Typen unterscheidenDeutsche Hodgkin Studiengruppe (GHSG). Histologie. http://www.ghsg.org/histologie; abgerufen am 25.11.2019. :