Myelodysplastische Syndrome sind eine Gruppe heterogener klonaler Erkrankungen der hämatopoetischen Stammzellen im Knochenmark. Die MDS-Pathogenese ist bisher nur unvollständig geklärt und sehr komplex. Man geht davon aus, dass für die Entstehung genetische Veränderungen in hämatopoetischen Stammzellen verantwortlich sind – zum Beispiel chromosomale Aberrationen, DNA-Mutationen und epigenetische Veränderungen, die beim Voranschreiten der Myelodysplasie häufig zunehmen. Vermutlich führt dies im Verlauf zu einer Selektion bösartiger Stammzellen. Diese besiedeln zunehmend das Knochenmark mit ihren Vorläuferzellen (Progenitorzellen), so dass die gesunde Blutbildung (Hämatopoese) verdrängt wird.
- Bei ca. der Hälfte der De-novo-MDS und bei bis zu 80 % der sekundären MDS sind Karyotypveränderungen im Knochenmark nachweisbar. Meist handelt es sich bei diesen zytogenetischen Veränderungen um unbalancierte Anomalien wie Deletionen oder Additionen von genetischem Material. Die am häufigsten beobachteten Veränderungen sind del(5q), -7 oder del(7q), +8, del(20q) und del(17p).
- In den letzten Jahren konnten dank neuer molekularer Untersuchungstechniken verschiedene Genmutationen identifiziert werden, die bei MDS häufig vorkommen, jedoch auch bei anderen Erkrankungen auftreten können: Dabei handelt es sich hauptsächlich um Mutationen in Genen, welche für Spleißfaktoren, epigenetische Regulatoren (z. B. zur DNA-Methylierung, Histonmodifikation) oder Transkriptionsfaktoren codieren. Bei etwa 90 % aller MDS-Patient:innen lässt sich mindestens eine der bislang bekannten Genmutationen nachweisen.
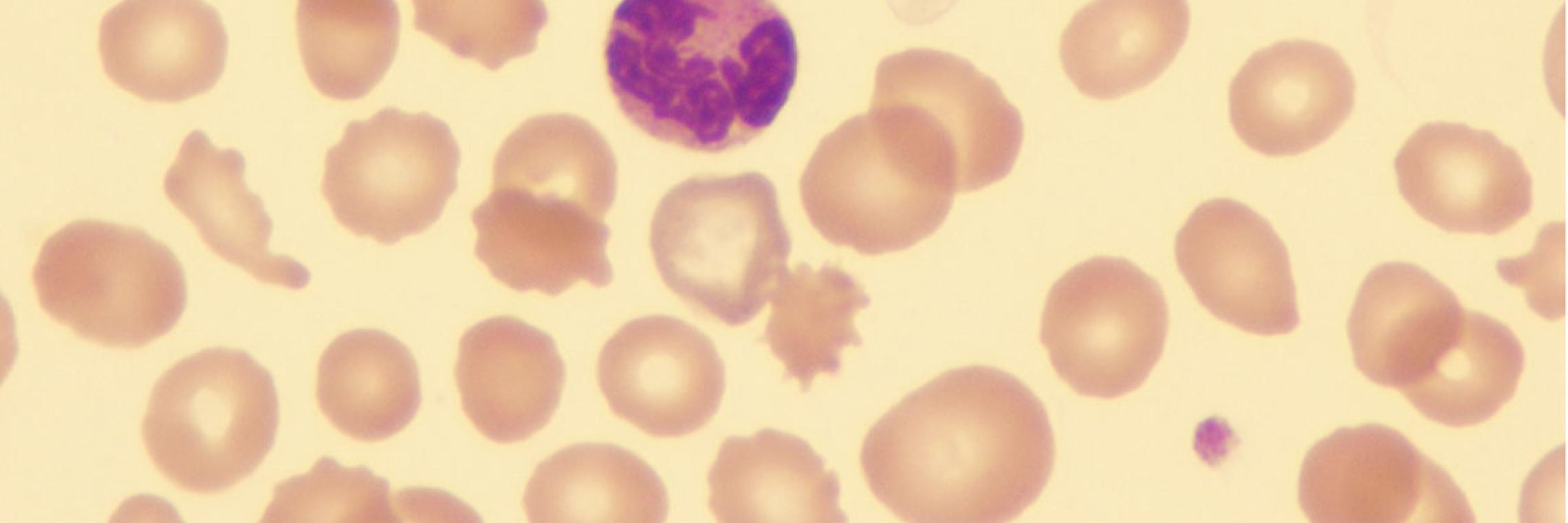
Im MDS-Krankheitsverlauf kommt es zu qualitativen und quantitativen Veränderungen in der Bildung der sogenannten myeloischen Blutzellen mit meist zellreichem dysplastischen Knochenmark und oft erhöhtem Blastenanteil sowie einer verminderten Bildung von peripheren Blutzellen (Zytopenie). Die Zytopenie kann isoliert auftreten oder gleich mehrere Linien von Blutzellenbetreffen (Anämie, Granulozytopenie, Thrombozytopenie). In bestimmten Fällen kann die Zahl der Blutzellen jedoch auch erhöht sein.