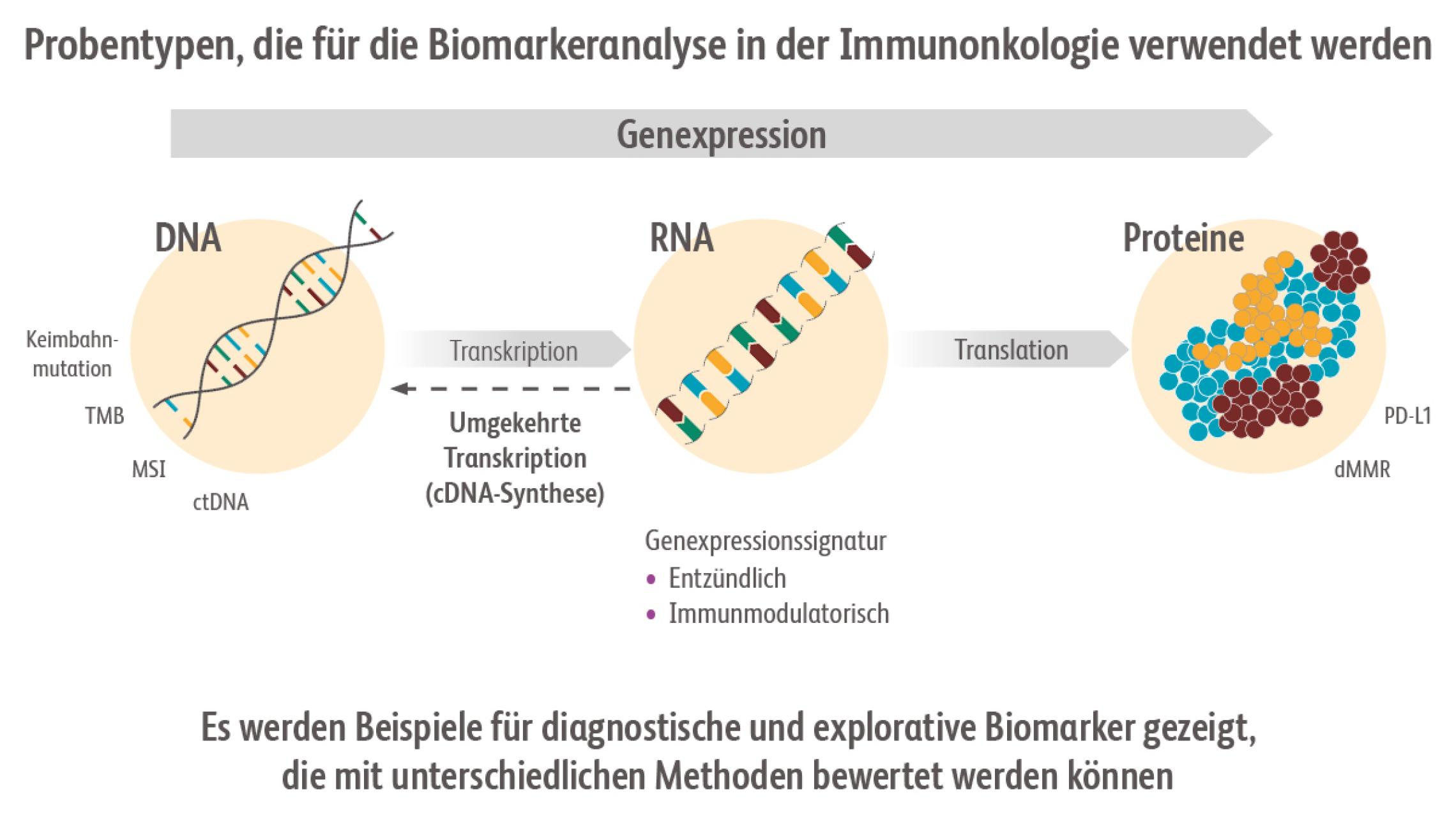
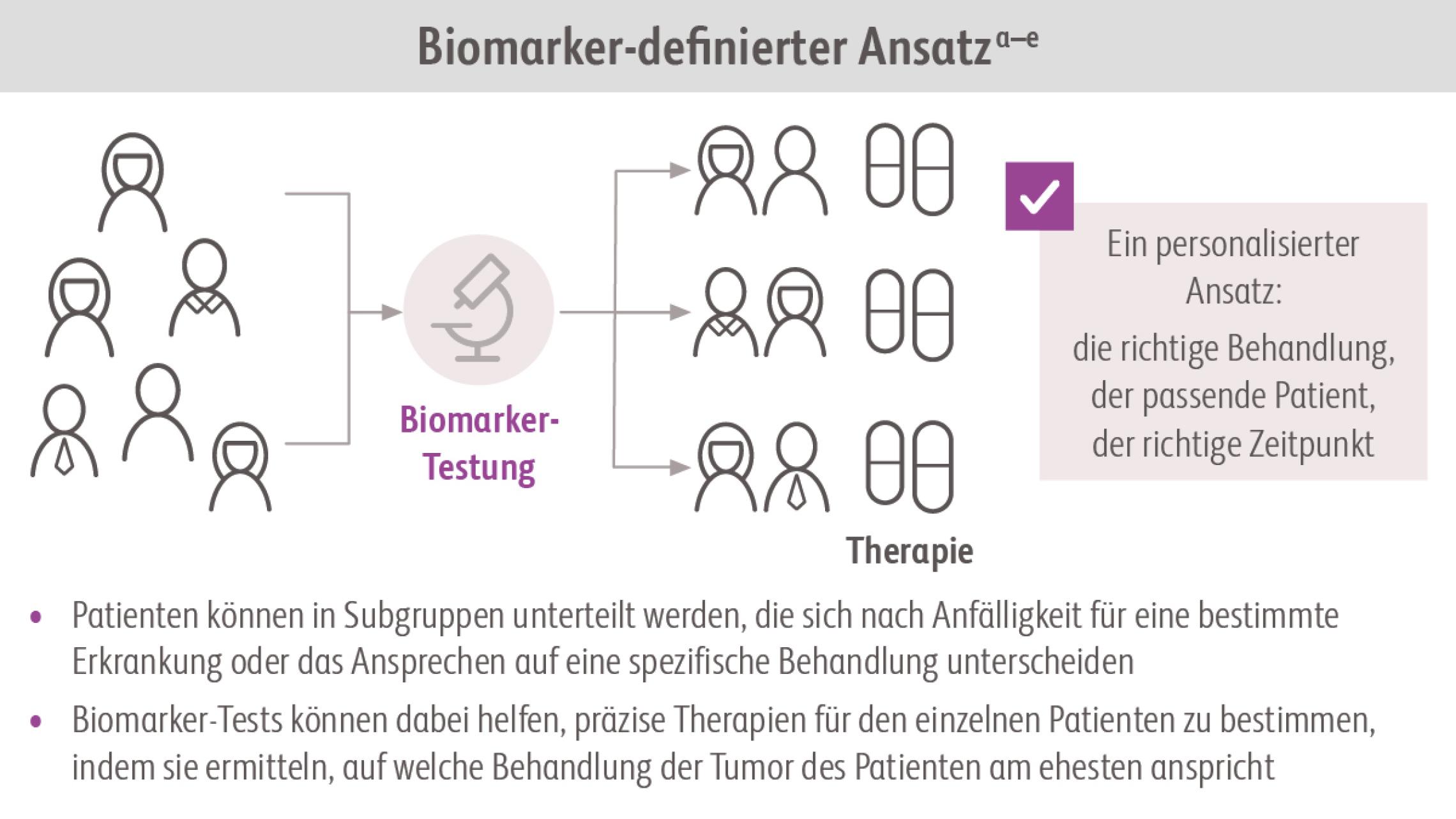
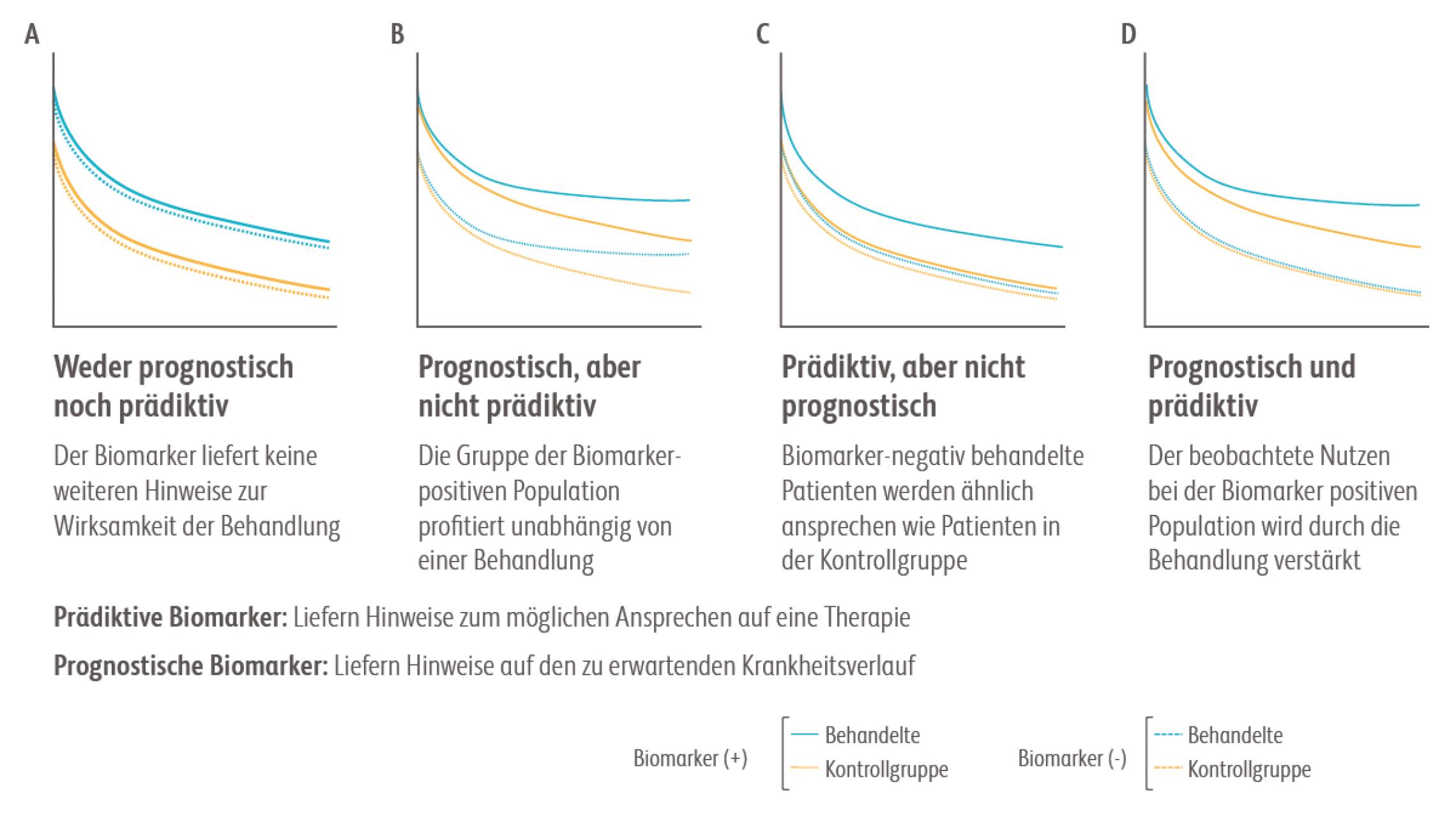
Zum Beispiel kann eine Abweichung der Expression eines Gens oder seines Genprodukts (Protein) nachgewiesen und als Biomarker verwendet werden. Die Höhe der Abweichung korreliert häufig mit dem Risiko für das Fortschreiten einer Erkrankung oder auch mit ihrem Ansprechen auf eine bestimmte Behandlung/Therapie.FDA-NIH Biomarker Working Group. BEST (Biomarkers, EndpointS, and other Tools) Resource. Abgerufen am 8.7.2022. https://www.ncbi.nlm.nih.gov/books/NBK326791/