Behandungssequenzen und Verlaufskontrollen

Präzisionsmedizin
Da jeder Patient einzigartig ist, ist auch sein Ansprechen auf eine Krebstherapie individuell. Aus diesem Grund forscht Bristol Myers Squibb weiter an klaren Orientierungshilfen mit dem Ziel, noch genauer bestimmen zu können, welcher Patient von welchem Behandlungsansatz und zu welchem Zeitpunkt profitiert, um ihm zukünftig maßgeschneiderte – personalisierte – Krebstherapien bieten zu können.Bundesärztekammer (BÄK). Präzisionsmedizin - Bewertung unter medizinisch-wissenschaftlichen und ökonomischen Gesichtspunkten. Abgerufen am 8.7.2022. https://www.bundesaerztekammer.de/themen/medizin-und-ethik/wissenschaftlicher-beirat/veroeffentlichungen/weitere-themen/praezisionsmedizin-bewertung-unter-medizinisch-wissenschaftlichen-und-oekonomischen-gesichtspunkten National Cancer Institute (NCI). NCI Dictionary of Cancer Terms. Abgerufen am 8.7.2022. https://www.cancer.gov/publications/dictionaries/cancer-termsFür Bristol Myers Squibb bedeutet Präzisionsmedizin daher die Kombination aus den folgenden drei Forschungsbereichen:
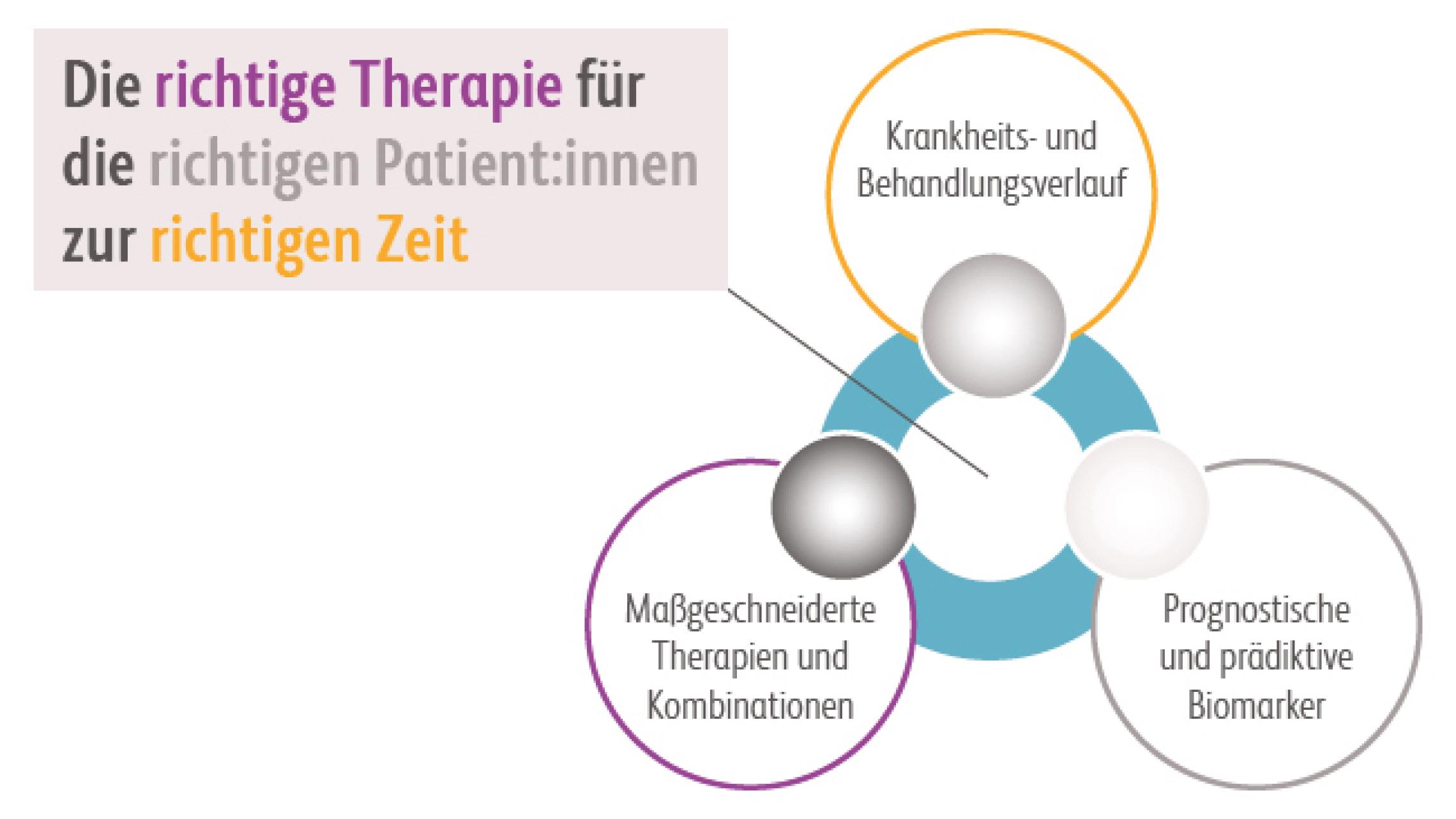
Behandungssequenzen und Verlaufskontrollen
Liquid Biopsy
Der richtige Zeitpunkt für den Einsatz bzw. Wechsel einer Therapie ist für die Krebsbehandlung essenziell. Daher werden geeignete Techniken und Marker untersucht, mithilfe derer eine Früherkennung bzw. ein Monitoring des Krankheits- sowie Therapieverlaufs möglich ist.
Prognostische und prädiktive Biomarker
Was ist ein Biomarker?
Erfahren sie hier, wie Biomarker die Therapieentscheidung in der Medizin und speziell in der Onkologie beeinflussen.
PD-L1
Welche Rolle spielt der Biomarker programmed death-ligand 1 in der Immunonkologie? Wie wird er bestimmt?
dMMR/MSI
Erfahren Sie hier, welche Rolle die DNA-Mismatch-Repair Defizienz/hohe Mikrosateliteninstabilität für die Immunonkologie spielt. Wie wird er bestimmt?
Maßgeschneiderte Therapien und Kombinationen
Wirkmechanismen und Therapieansätze
In der Onkologie stehen mittlerweile zahlreiche Behandlungsoptionen mit verschiedensten Wirkmechanismen und Techniken zur Verfügung. Erfahren Sie hier mehr zu den maßgeschneiderten Therapieansätzen von Bristol Myers Squibb.