Chimärer Antigenrezeptor (CAR) Hartmann J, Schussler-Lenz M, Bondanza A, Buchholz CJ. Clinical development of CAR T cells-challenges and opportunities in translating innovative treatment concepts. EMBO Mol Med. 2017;9(9):1183-1197. doi:10.15252/emmm.201607485 Dai H, Wang Y, Lu X, Han W. Chimeric Antigen Receptors Modified T-Cells for Cancer Therapy. J Natl Cancer Inst. 2016;108(7)doi:10.1093/jnci/djv439 Watanabe N, Bajgain P, Sukumaran S, et al. Fine-tuning the CAR spacer improves T-cell potency. Oncoimmunology. 2016;5(12):e1253656. doi:10.1080/2162402X.2016.1253656
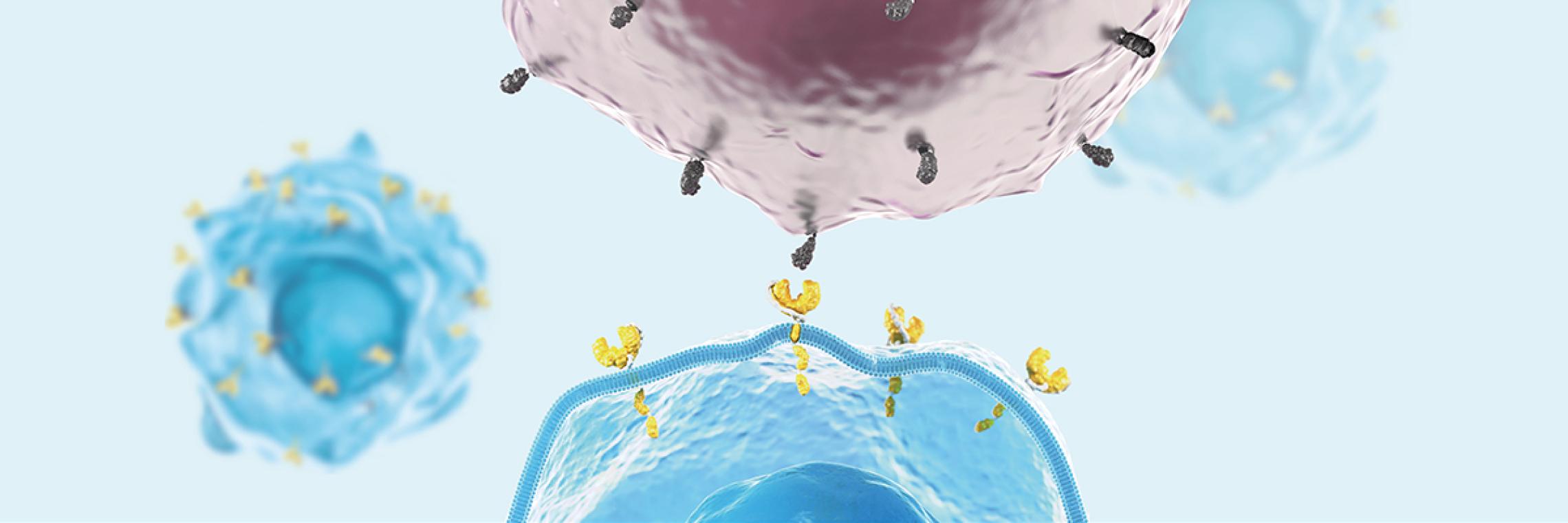
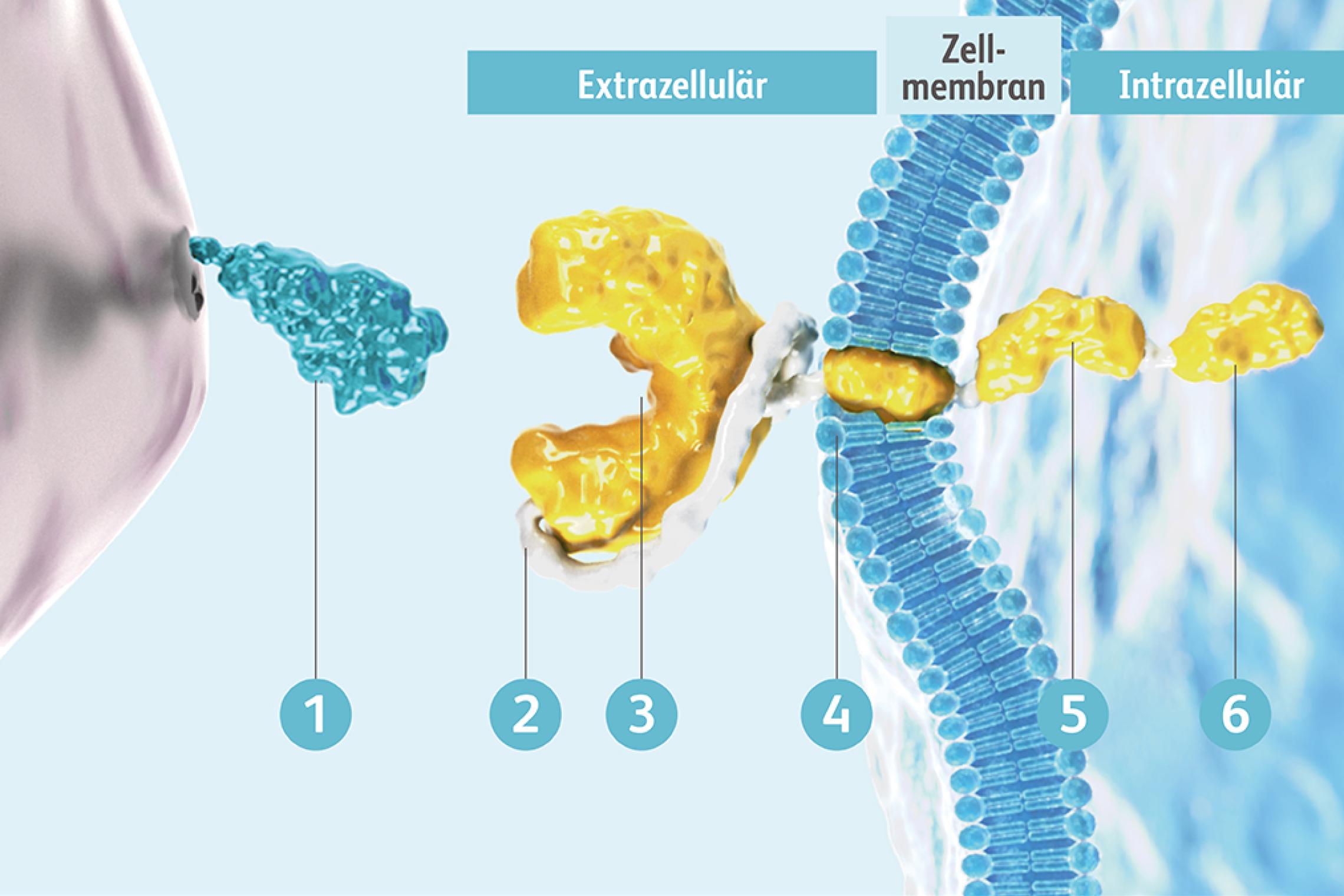
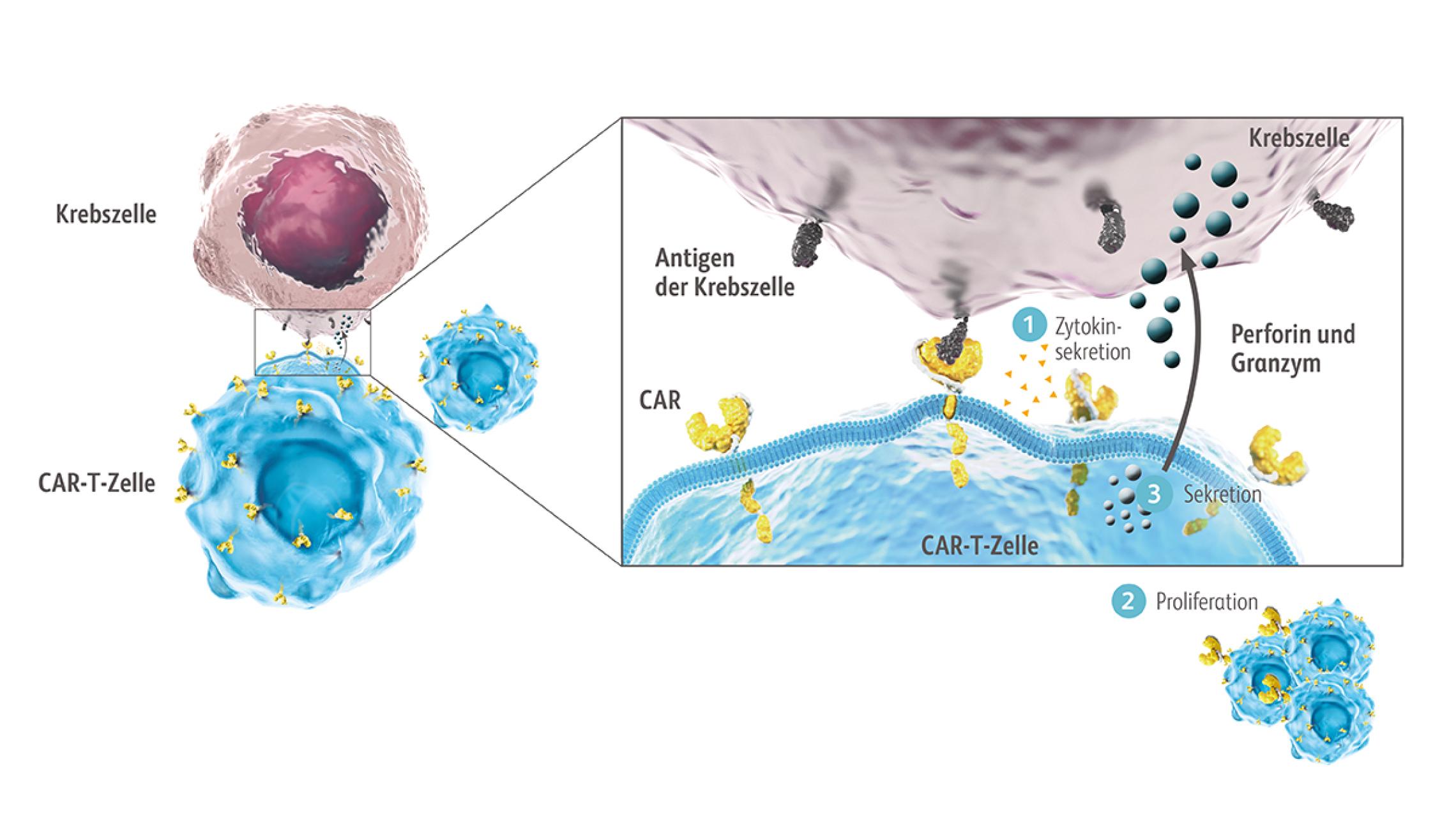
Der CAR ist ein eigens für die CAR-T-Zelltherapie entwickeltes Fusionsprotein, das verschiedene Mechanismen der T-Zell-Aktivierung in einem Protein vereint. Über diesen CAR können CAR-T-Zellen Antigene erkennen und binden, woraufhin die Aktivierungskaskade in die CAR-T-Zelle hinein weitergeleitet wird. Der CAR besteht aus einer extrazellulären Antigen-bindenden Domäne, einer Transmembrandomäne und einer intrazellulären Domäne. Die extrazelluläre Domäne ist vom Single-chain variable fragment (scFv)-Segment der Antigen-Bindungsregion eines monoklonalen Antikörpers abgeleitet. Die intrazellulären Domänen besitzen Bestandteile des T-Zell-Rezeptors und vermitteln die Aktivierung der CAR-T-Zellfunktion.Maus MV, Levine BL. Chimeric Antigen Receptor T-Cell Therapy for the Community Oncologist. Oncologist. 2016;21(5):608-17. doi:10.1634/theoncologist.2015-0421 Dazu gehören die Aktivierungsdomäne CD3ζ, die bereits eine potente zytotoxische T-Zellantwort ermöglicht, sowie eine kostimulatorische Domäne.